29. Juni 2023
DNA-Organisation in Echtzeit
Wie die Dynamik der DNA die Genaktivität steuert
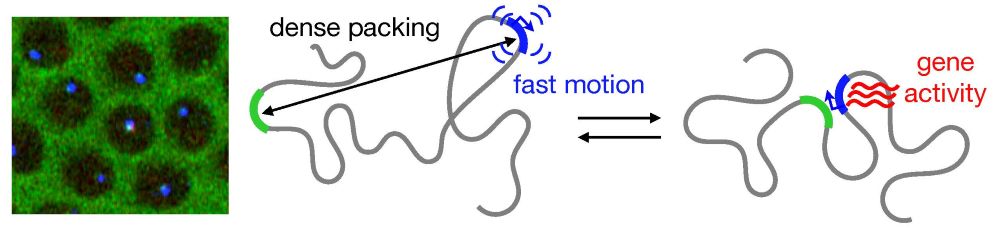
Obwohl Chromosomen, die unsere genetische Information speichern, dicht gepackt sind, damit sie in den Zellkern passen, sind sie ständig in Bewegung. Bestimmte Regionen müssen in Kontakt kommen, damit ein Gen aktiviert werden kann. Eine Gruppe von Wissenschafter:innen des Institute of Science and Technology Austria (ISTA), der Princeton University und des Pasteur Instituts in Paris hat diesen dynamischen Prozess nun visualisiert. Das gibt uns neue Einblicke in die physikalischen Eigenschaften der DNA.

Oftmals benötigt Spitzenforschung einen Blick über den eigenen Tellerrand sowie das Verbinden wissenschaftlicher Disziplinen. Manchmal bedeutet das sogar, zur richtigen Zeit am richtigen Ort zu sein. Für David Brückner, Postdoktorand und NOMIS-Stipendiat am ISTA, kamen all die oben genannten Dinge zum Tragen, als er eine Vorlesung von Professor Thomas Gregor von der Princeton University am ISTA-Campus besuchte. Inspiriert durch den Vortrag, nahm Brückner Kontakt auf – mit einem Ziel: die von Gregor präsentierten spezifischen Datensätze physikalisch zu interpretieren. Nun erscheinen die Resultate der gemeinsamen Arbeit in der Zeitschrift Science. Sie zeigen die stochastische (zufällige) Bewegung im dreidimensionalen Raum von zwei spezifischer Genelemente auf einem Chromosom, die sich berühren müssen, damit ein Gen aktiv wird.
Wie die DNA in den Zellkern passt
Lebende Organismen wie wir Menschen sind auf Genen aufgebaut, die in unserer DNA gespeichert sind – unseren eigenen molekularen Bauplan. Die DNA ist ein Polymer, also ein riesiges Molekül aus kleineren Einzelteilen (Monomeren) und befindet sich im Kern jeder Zelle. „Je nach Organismus kann das DNA-Polymer bis zu einem Meter lang sein, während die Größe des Zellkerns in der Größenordnung von Mikrometern liegt“, erklärt Brückner. Um in den winzigen Zellkern zu passen, wird die DNA kompaktiert, indem sie wie auf einer Spule aufgewickelt und weiter in die bekannte Form der Chromosomen gepresst wird, die wir alle aus dem Biologielehrbuch kennen.
„Trotz dieser starken Komprimierung sind Chromosomen nicht statisch, sondern wackeln ständig herum“, so der Physiker weiter. Diese Dynamik ist sehr wichtig. Immer wenn ein bestimmtes Gen aktiviert werden soll, müssen zwei Regionen auf dem Polymer – „Enhancer“ und „Promoter“ genannt –in engen Kontakt kommen und sich verbinden. Erst dann liest eine zelluläre Maschinerie die Information des Gens ab und bildet das RNA-Molekül. Aus ihm entstehen schließlich Proteine, die für alle Prozesse, die ein lebender Organismus benötigt, unerlässlich sind.
Je nach Organismus können der Enhancer und der Promotor auf dem Chromosom recht weit voneinander entfernt sein. „Mit bisher verwendeten Methoden konnte man einen statischen Blick auf den Abstand zwischen diesen Elementen werfen, aber nicht darauf, wie sich das System im Laufe der Zeit entwickelt“, erklärt Brückner. Angesichts dieser fehlenden Informationen machten sich die Wissenschafter:innen daran, einen dynamischen Blick darauf zu werfen, wie diese Elemente organisiert sind und wie sie sich im dreidimensionalen Raum in Echtzeit bewegen.
Visualisierung von Genregionen
Um dieses Ziel zu erreichen, haben die Wissenschafter:innen aus Princeton eine Methode entwickelt, wie sie diese beiden DNA-Elemente über einen bestimmten Zeitraum in einem Fliegenembryo beobachten können. Durch Genmanipulation wurden die DNA-Elemente fluoreszierend markiert, wobei die Enhancer-Region grün und der Promotor blau leuchtete. Mithilfe von Live-Imaging (Zeitraffermikroskopie lebender Zellen) konnten die Wissenschafter:innen die fluoreszierenden Punkte in Fliegenembryonen sichtbar machen. Das gab Aufschluss darüber, wie sie sich bewegten und sich gegenseitig finden.
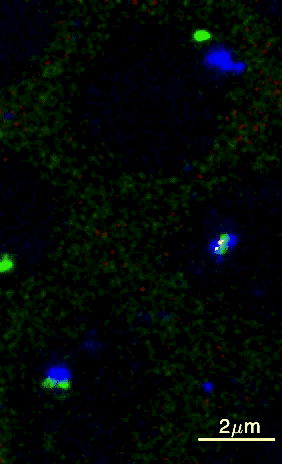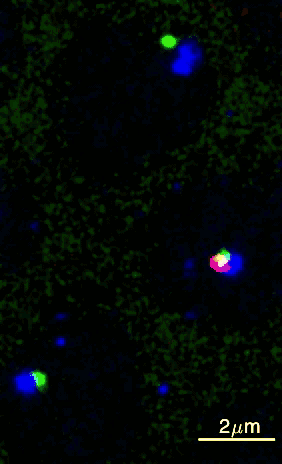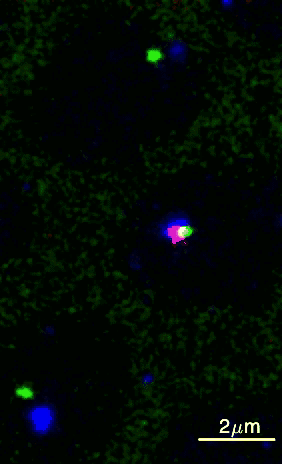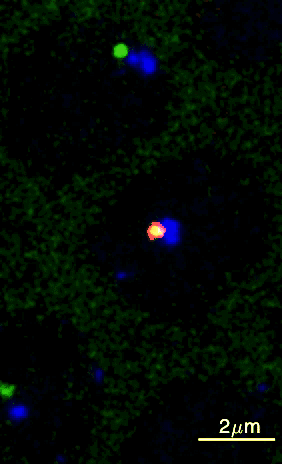
Sobald sich die beiden Punkte berührten, wurde das Gen aktiviert und ein zusätzliches rotes Licht leuchtete auf, da die RNA ebenfalls mit roten Fluorophoren markiert worden war. Brückner fügt aufgeregt hinzu: „Wir konnten dadurch visuell ablesen, wann der Enhancer und der Promotor in Kontakt kamen, was uns eine Menge an Information über deren Verlauf lieferte.“
DNA: Dicht gepackt und in schneller Bewegung
Die Herausforderung bestand nun darin, diesen riesigen Datensatz stochastischer Bewegungen zu analysieren. Als theoretischer Physiker war Brückner in der Lage, Statistiken zu extrahieren, um das typische Verhalten des Systems zu verstehen. Er wandte zwei vereinfachte, unterschiedliche physikalische Modelle an, um die Daten zu durchschauen.
Eines davon war das sogenannte Rouse-Modell. Es geht davon, dass jedes Monomer des Polymers eine elastische Feder ist. Es sagt eine lockere Struktur und eine schnelle Diffusion – die zufällige Bewegung, bei der die Genregionen gelegentlich aufeinandertreffen – voraus. Das andere wird als „fractal globule-Modell“ (zu Deutsch etwa „fraktales Kugelförmiges“) bezeichnet. Es geht von einer sehr kompakten Struktur und damit einer langsamen Diffusion aus. „Überraschenderweise fanden wir in den Daten, dass das System durch eine Kombination dieser beiden Modelle am besten beschrieben wird. Also eine äußerst dichte Struktur, die man auf der Grundlage des fractal globule-Modells erwarten würde, und Diffusion, die durch die Statistik des Rouse-Modells beschrieben wird“, erklärt Brückner.
Aufgrund der dichten Packung und der schnellen Bewegung hängt die Bindung dieser beiden Genregionen viel weniger von ihrem Abstand entlang des Chromosoms ab, als bisher angenommen wurde. „Wenn sich ein solches System die ganze Zeit über in einem fließenden und dynamischen Zustand befindet, ist die Kommunikation über große Entfernungen viel besser als wir gedacht haben“, ergänzt Brückner.
Diese Studie vereint die Welten der Biologie und der Physik. Für Physiker:innen ist sie interessant, da die Wissenschafter:innen die Dynamik eines komplexen biologischen Systems mit langem bekannt physikalischen Theorien getestet haben, und für Biolog:innen gibt sie Einblicke in die Eigenschaften der Chromosomen, die dazu beitragen können, die Geninteraktion und Genaktivierung genauer zu verstehen.
Publikation:
D. B. Brückner, H. Chen, L. Barinov, B. Zoller & T. Gregor. 2023. Stochastic motion and transcriptional dynamics of pairs of distal DNA loci on a compacted chromosome. Science. DOI: 10.1126/science.adf5568
Projektförderung:
Der ISTA-Teil dieses Projekts wurde durch Mittel der NOMIS Foundation und durch ein EMBO-Postdoktorandenstipendium (ALTF 343-2022) an D. B. Brückner finanziert.
Information zu Tierversuchen:
In dieser Studie wurde ein nicht geschützter Drosophila-Laborstamm verwendet; alle Verfahren wurden vom Institutional Animal Care and Use Committee der Princeton University genehmigt.



