21. April 2017
Gleich und doch anders
Forscherteam am IST Austria entdeckt Mechanismus, durch den Bakterien mit demselben Genotyp einen unterschiedlichen Phänotyp haben können │Studie erscheint in Science
Bakterienpopulationen stellen ForscherInnen vor ein Rätsel: in sogenannten isogenen Populationen haben alle Bakterien dieselben Gene, verhalten sich aber trotzdem unterschiedlich, indem sie etwa unterschiedlich schnell wachsen. ForscherInnen des Institute of Science and Technology Austria (IST Austria) haben nun einen Teil dieses Rätsels gelöst, indem sie untersuchten, wie das Bakterium Escherichia coli einen Proteinkomplex aufteilt, der verschiedene Medikamente, wie etwa Antibiotika, aus der Zelle pumpt und so die Zelle entgiftet. Sie fanden, dass die Pumpenproteine bei der Zellteilung so verteilt werden, dass eine Zelle mehr von ihnen erhält als die andere. Bakterienzellen, die mehr Pumpenproteine erben, wachsen in niedrigen Konzentrationen von Antibiotika schneller. Die Aufteilung des Pumpenproteins ist ein Weg, auf dem unterschiedliches Verhalten in einer Bakterienpopulation entstehen kann, und kann ein Sprungbett für die Entwicklung von Resistenzen gegenüber Antibiotika sein. Die Studie erscheint in Science und wurde von einem interdisziplinären Forscherduo durchgeführt: einem Experimentalwissenschaftler, Tobias Bergmiller, und einer Theoretikerin, Anna Andersson, aus den Gruppen von Călin Guet und Gašper Tkačik am IST Austria.
Eine Bakterienpopulation besteht aus tausenden Bakterien, die alle dasselbe genetische Material besitzen. Aber diese Individuen können eine Bandbreite an Phänotypen aufweisen, sich also durch Aussehen und Verhalten voneinander unterscheiden. Der Grund dafür sind zufällige Prozesse in den Zellen, die beeinflussen, wie die genetischen Instruktionen verwendet werden. Für Proteine im Zytosol, der Flüssigkeit im Inneren der Zelle, sind diese zufälligen molekularen Prozesse etwa Unterschiede im Abbau von Proteinen, oder die zufällige Aufteilung in die zwei Zellen, die sich während der Zellteilung bilden. In der vorliegenden Studie untersuchten die ForscherInnen, wie ein Proteinkomplex in der Zellhülle, die die Zelle umschließt, zu dieser Heterogenität oder Vielfalt an Phänotypen führt.
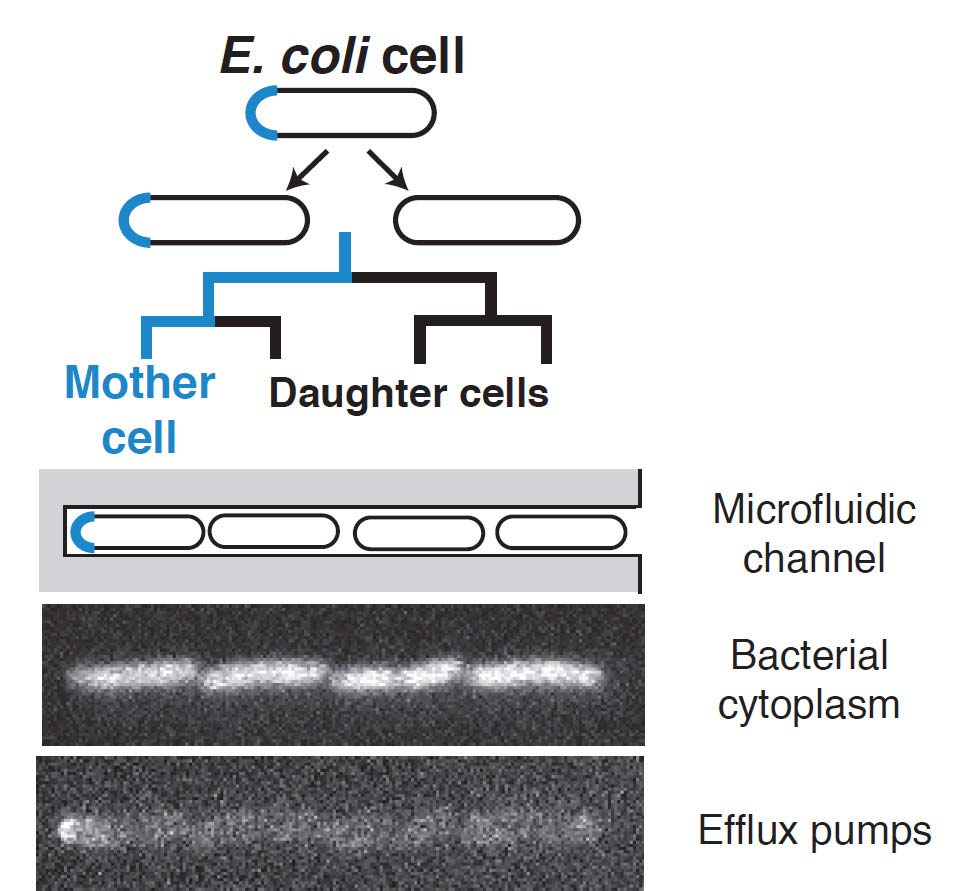
AcrAB-TolC, der untersuchte Proteinkomplex, ist der Hauptproteinkomplex, der Medikamente und Gifte aus den Escherichia coli Zellen pumpt. Es befindet sich in der Zellhülle, in der sich Proteine als „Inseln“ gruppieren. Anders als im Zytosol, wo die Proteine durch Diffusion generell gut gemischt sind, können sich die Proteine in der Zellhülle asymmetrisch segregieren. Manche dieser Cluster bilden sich am Zellpol, den gerundeten Enden von stäbchenförmigen Bakterien wie Escherichia coli. In diesen Bakterien können die Zellen, die bei der Zellteilung „geboren“ werden, durch ihre Zellpole voneinander unterschieden werden. Eine Zelle, die Mutterzelle, behält einen alten Zellpol der bei einer vorangegangenen Teilung entstand und wo Effluxpump-Proteine bereits stabile Cluster gebildet haben.
Die AutorInnen zeigen, dass sich AcrAB-TolC an diesen alten Zellpolen der Mutterzellen ansammeln. Diese Mutterzellen können Medikamente effizienter aus der Zelle pumpen als die Tochterzellen, die die alten Zellpole nicht erbten. In niedrigen Antibiotikakonzentrationen können die Mutterzellen schneller als die Tochterzellen wachsen. Basierend auf diesen Beobachtungen entwickelten die ForscherInnen ein mathematisches Modell um zu identifizieren, wie die unausgewogene Verteilung der Medikamentenpumpe die Bakterienpopulation betrifft. Sie fanden, dass die Mutterzellen, die die Medikamente schneller hinauspumpen, häufiger werden. Die Population wird heterogen während sich dieser extreme Phänotyp weiterverbreitet, da diese Heterogenität langlebig ist.
Călin Guet erklärt, wie die unausgewogene Verteilung der Pumpe ein Schritt auf dem Weg zur Antibiotikaresistenz sein kann: „Aktuelle Forschung anderer Gruppen hat gezeigt, dass Mutationen, die Antibiotikaresistenz verursachen, bei niedrigen Antibiotikakonzentrationen schnell entstehen. Solche niedrigen Konzentrationen finden sich zunehmend in natürlichen Habitaten oder in PatientInnen während der Medikamenteneinnahme. Tatsächlich zeigten Studien, die die Selektion durch Antibiotika untersuchten, dass AcrAB, die von uns untersuchten Gene, amplifiziert waren. Heterogenität in einer Bakterienpopulation, die durch einen Mechanismus der unausgewogenen Verteilung von Medikamentenausflusspumpen entstehen, wie wir sie in unserer Studie identifiziert haben, könnte ein Sprungbrett auf dem Weg von Bakterienpopulationen hin zur Antibiotikaresistenz sein.“



