26. März 2019
Neues Gen mit möglicher Rolle bei Metastasierung identifiziert
Immunzellen bleiben im Kopf der Fruchtfliege stecken
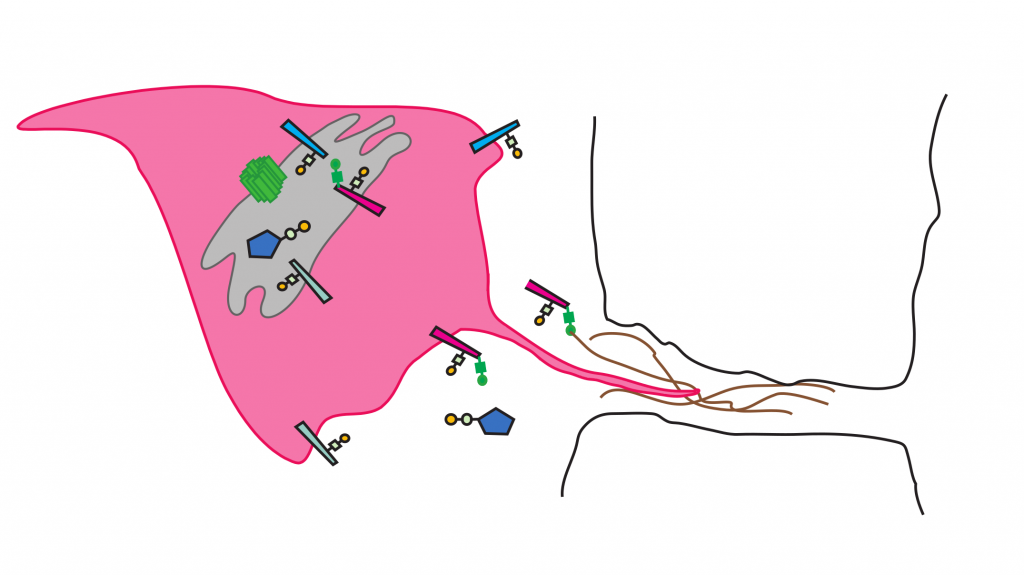
Minerva (grün) reguliert, wie T-Antigen (gelb) an Immunzellen (rosa)
von Fruchtfliegen angefügt wird. © Daria Siekhaus
Weisen Tumore eine bestimmte Kombination von Zuckern – das sogenannte T-Antigen – auf, breiten sie sich mit größerer Wahrscheinlichkeit im Körper aus und töten den Patienten. Was jedoch das Auftreten von T-Antigen in Krebszellen reguliert, welche Proteine mit T-Antigen modifiziert werden und welche Rollen das T-Antigen und die damit modifizierten Proteine während der Bildung von Metastasen spielen, ist noch unbekannt. Eine neue Studie der Forschungsgruppe um Daria Siekhaus am Institute of Science and Technology Austria (IST Austria), mit den Erstautorinnen Katarína Valošková und Julia Bibl, identifizierte ein neues Gen in der Fruchtfliege Drosophila, das benötigt wird, um das Anfügen von T-Antigen an eine Subgruppe von Proteinen in Immunzellen zu regulieren. Ist das Gen mutiert, bleiben die Immunzellen im Kopf der Fliege stecken. Daher benannte das Team das neue Gen nach der römischen Göttin der Weisheit, Minerva, die dem Kopf ihres Vaters Jupiter entsprang. Die heute im Fachjournal eLife erscheinende Studie ist ein erster Schritt, um zu verstehen, wie Zuckermodifizierungen bei der Metastasenbildung involviert sein könnten.
Die Fruchtfliege als ein Motor für Entdeckungen
Wenn Krebszellen metastasieren, verlassen sie den ursprünglichen Ort des Tumors und drängen zwischen anderen Zellen hindurch in die Blutbahn, die sie quasi als „Autobahnen“ durch den Körper nutzen. Um die Blutbahn zu verlassen, zwängen sich die metastasierenden Zellen wiederum zwischen Zellen hindurch in das Gewebe, wo sie Metastasen bilden. T-Antigen, eine Kombination bestimmter Zuckermoleküle, ist auf den Proteinen metastasierender menschlicher Krebszellen zu finden. In den meisten anderen adulten Geweben ist es dagegen normalerweise nicht vorhanden. Immunzellen der Fruchtfliege, sogenannte Makrophagen, tragen auch T-Antigene und zwängen sich ebenfalls zwischen Zellen hindurch, um in Gewebe einzudringen. Daher beschlossen Daria Siekhaus und ihre Gruppe, die Fruchtfliege und ihre Immunzellen als Modell zu verwenden, anhand dessen sie untersuchten, wie das Auftreten von T-Antigen auf Proteinen reguliert wird und welche Proteine davon betroffen sind. „Die Fruchtfliege ist der ideale Organismus, um neue Wirkungspfade zu finden, denn komplexe genetische Experimente können mit Fliegen schnell durchgeführt werden. Hier nutzen wir wieder die Fliege als Quelle für Entdeckungen bei einer Fragestellung, die auch uns Menschen betrifft“, erklärt Daria Siekhaus.
Zunächst suchte das Team all jene Gene, die möglicherweise involviert sein konnten. „Wir sahen uns die Gendatenbanken für Fliegen an, um ein Gen zu finden, das zur richtigen Zeit am richtigen Ort aktiv ist: Ein Gen, das dann in Makrophagen aktiv ist, wenn das T-Antigen angefügt wird, und das im Golgi-Apparat aktiv ist, in dem Zucker wie das T-Antigen an Proteine angefügt werden, bevor sie zur Zelloberfläche transportiert werden.“ Als die Gruppe einen solchen Gen-Kandidaten gefunden hatte, der bis dahin nur unter dem Platzhalter „CG8602“ bekannt war, testeten sie seine Rolle beim Anfügen des T-Antigens. Die Forscherinnen fanden, dass die Makrophagen weniger T-Antigen tragen, wenn CG8602 mutiert ist. Außerdem verlassen die Makrophagen in diesem Fall nicht die Kopfregion des Fliegenembryos, um in andere Gewebe vorzudringen, wie sie es sonst tun würden. Gemäß der Tradition der Fruchtfliegen-Forschung, der zufolge Gennamen, die bei einer Mutation beobachteten Veränderungen beschreiben, nannte die Gruppe das Gen „Minerva“, nach der römischen Göttin der Weisheit. Antiken römischen Mythen zufolge verwandelte sich Minervas schwangere Mutter in eine Fliege, welche von Minervas Vater Jupiter verschluckt wurde. Nach ihrer Geburt war Minerva ursprünglich in Jupiters Kopf gefangen, bevor sie in voller Kriegsmontur aus ihm hervorbrach.
Entsprechende Gene bei Wirbeltieren für Krebs relevant
Die ForscherInnen untersuchten, an welche Proteine Minerva das T-Antigen anfügt. Durch die Zusammenarbeit mit Sergey Vakhrushev und Henrik Clausen von der Universität Kopenhagen hatten die ForscherInnen Zugang zu einer Massenspektrometrie-Technik, mit der sie herausfinden konnten, welche Proteine die T-Antigen Zucker tragen, wenn Minerva vorhanden ist, und weniger T-Antigen tragen, wenn Minerva mutiert ist. Sie fanden so einen Satz Proteine, die Minerva benötigen, um T-Antigen zu tragen. Die Mehrheit der identifizierten Proteine, die auch ein Pendant in Wirbeltieren – ein sogenanntes Ortholog – haben, spielen bei Krebs eine Rolle. „Neun der Proteine, die wir fanden, haben im Menschen ein Ortholog. Sechs davon stehen auf irgendeine Art und Weise mit Krebs in Verbindung. Das ist faszinierend!“, erklärt Siekhaus.
Die WissenschafterInnen brachten das Wirbeltier-Ortholog von Minerva, MFSD1, in Fliegen ein, die Minerva nicht mehr hatten. Dabei sahen sie, dass die sonst steckengebliebenen Makrophagen den Kopf verließen und sie wieder einen höheren Spiegel des T-Antigens aufwiesen. Das weist auf eine spannende Möglichkeit hin, hebt Siekhaus hervor: „Das könnte bedeuten, dass die Funktion von Minerva in Wirbeltieren beibehalten wird. Das Ortholog von Minerva in Wirbeltieren, MFSD1, könnte eine Rolle bei der Regulierung von Zuckern und bei der Metastasenbildung spielen. Wir sehen uns jetzt Wirbeltier-Krebsmodelle an, um zu sehen, ob und wie MFSD1 die Migration und Invasion von Krebszellen reguliert.“
Publikation:
Katarina Valoskova, Julia Biebl, Marko Roblek, Shamsi Emtenani, Attila Gyoergy, Michaela Misova, Aparna Ratheesh, Patricia Reis-Rodrigues,Kateryna Shkarina, Ida Signe Bohse Larsen, Sergey Y. Vakhrushev, Henrik Clausen & Daria E. Siekhaus. 2019. A conserved major facilitator superfamily member orchestrates a subset of O-glycosylation to aid macrophage tissue invasion, eLife 2019;8:e41801. DOI: 10.7554/eLife.41801



