3. Mai 2023
Tanzstile der Atome
Wie ISTA Forscher:innen mit NMR-Spektroskopie Moleküle untersuchen
Die Kernspinresonanzspektroskopie (NMR-Spektroskopie) ist eine wissenschaftliche Methode, mit der man strukturelle Details von Molekülen entschlüsseln kann. Sie ist eine der neuesten Techniken am Institute of Science and Technology Austria (ISTA) und ist wegen einer aktuellen Publikation der Schanda Gruppe sowie dem gerade stattfindenden NMR-Symposium in aller Munde. Aber wie funktioniert NMR, warum ist sie für Wissenschafter:innen wichtig und was hat Tanzen damit zu tun?

Als Teil der wissenschaftlichen Services (Scientific Service Units, SSUs) am ISTA findet sich eine spektakuläre Halle mit dem Flair einer Raumstation, riesigen supraleitenden Magneten, Kühlaggregaten, Pumpen und Kompressoren. Die Rede ist von der NMR Facility.
Was einer Raumstation anmutet, ist eigentlich ein viel genutzter Ort für Chemiker:innen und Biochemiker:innen am Campus. Für sie ist die NMR-Spektroskopie eine Methode, um Molekülen aller Größen zu untersuchen: von sehr kleinen bis hin zu großen Biomakromolekülen, wie Proteinen oder DNA. Mit diesem Instrument gewinnen sie Erkenntnisse über die physikalischen, chemischen und biologischen Eigenschaften von Molekülen.
NMR – Ein Radiosender für Atome
Eine Sache vorweg: Das aus dem Englischen übersetzte Wort „nuklear“ in NMR (Nuclear Magnetic Resonance) hat nichts mit der Nuklear/Kernenergie zu tun. Es bezieht sich viel mehr auf die Kerne (das Zentrum) der Atome – winzige Bausteine, aus denen alle Materialien bestehen. Die magnetischen Eigenschaften dieser Kerne sind für die Kernspinresonanz verantwortlich. Das ist ein physikalischer Effekt, bei dem die Kerne eines beliebigen Materials elektromagnetische Wellen absorbieren und auch aussenden, wenn sie einem großen äußeren Magnetfeld ausgesetzt werden – die Grundlage der NMR-Spektroskopie.
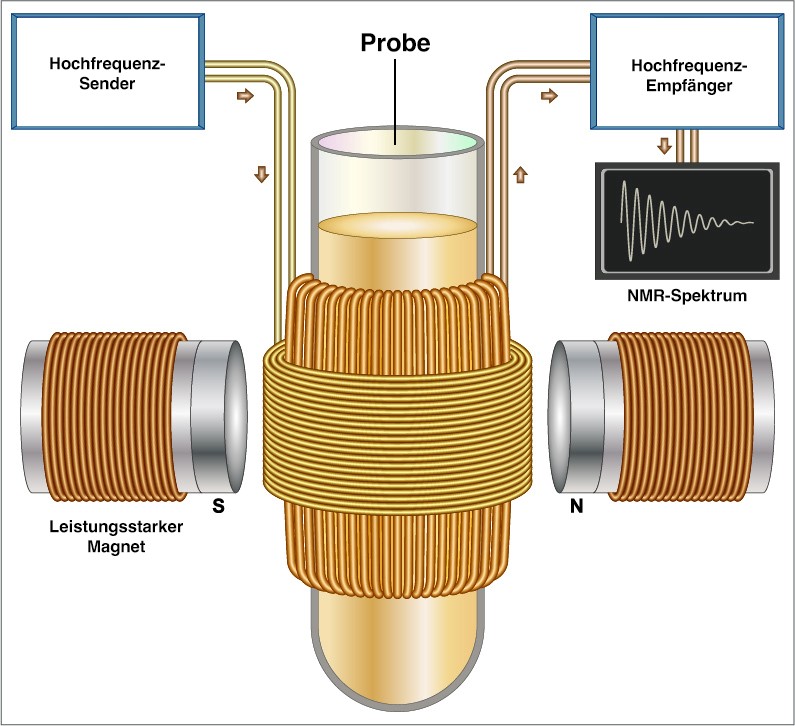
Um Moleküle zu erforschen, wird die zu untersuchende Probe in einen Magneten gelegt und mit elektromagnetischen Wellen bestrahlt. Deren Reaktion wird danach aufgezeichnet und ergibt das NMR-Spektrum. Petra Rovó, die Managerin der NMR Facility, erklärt: „Wir verwenden Hochfrequenzstrahlung. Diese Wellenlängen sind die gleichen, die auch lokale Radiosender verwenden.“ Sie beschreibt, dass die Atome in Molekülen ihre „Lieblingslieder“ aus dem NMR-Radiosender „hören“. „Jedes Atom hat einen einzigartigen ‚Tanzstil‘, der sich in einer leicht unterschiedlichen Frequenz des Wackelns und Springens äußert. Anschließend, zeichnen wir den Tanz aller Atome auf, und können mit einem mathematischen Trick jede Frequenz einzeln auslesen“, so Rovó weiter. Die einzelnen Frequenzen liefern die Information über benachbarte Atome und Atomgruppen innerhalb einer Verbindung und ermöglichen schließlich die Konstruktion einer 3D-Darstellung der Molekularstruktur.

Wenn NMR auf Biochemie trifft
ISTA-Professor und Biochemiker Paul Schanda ist ein regelmäßiger Nutzer der NMR-Spektroskopie. Seine Forschungsgruppe interessiert sich dafür, wie Biomoleküle, beispielsweise Proteine, ihre Aufgaben erfüllen. Proteine sind lange Molekülen aus Aminosäureketten und sind für fast alles verantwortlich, was eine biologische Zelle leistet, damit sich das Leben entfalten kann. Sie führen chemische Reaktionen durch, wandeln Licht in unseren Augen in elektrische Signale um und vieles mehr.
Die korrekte Ausführung dieser Prozesse ist wichtig für die Gesundheit des Menschen. Kleinste Veränderungen in der Struktur eines Proteins können schwerwiegende Folgen haben. „Proteine können in einer anderen Architektur vorkommen, als sie eigentlich sollten. Zum Beispiel, wenn sie Ablagerungen im Gehirn von Alzheimerpatient:innen bilden, welche auch als Amyloid-Fibrillen bekannt sind – lange fadenförmige Strukturen mit immenser Bedeutung für neurologische Pathologien“, erklärt Schanda.
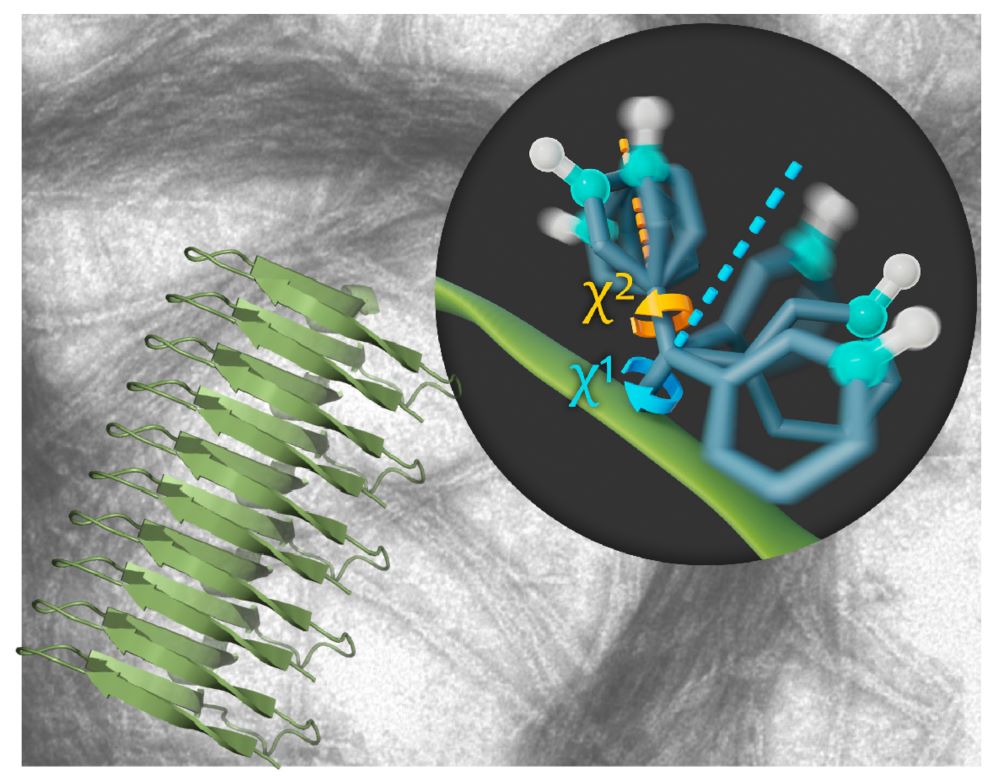
In ihrer aktuellsten Studie untersuchte die Gruppe die Dynamik von Amyloid-Fibrillen. Dafür benützten sie eine spezielle, hochauflösende NMR-Spektroskopie-Methode. „Moleküle sind nicht statisch. Sie sind ständig in Bewegung – bei vielen Proteinen sind diese Bewegungen für ihre Funktion unerlässlich“, fährt Schanda fort. „NMR ist eine leistungsstarke Methode zur Untersuchung dieser Bewegungen. Sie ermöglicht es uns, die Bewegungen einzelner Atome oder Aminosäure-Seitenketten innerhalb einer 3D-Struktur zu ‚beobachten‘.“ Die Ergebnisse geben einen noch nie dagewesenen detaillierten Einblick in die Fibrillenstruktur und zeigen, dass sie sich aus einem sehr starren Kern und sich schnell bewegenden Seitenketten auf der Außenseite zusammensetzen.
Wissenschafter:innen zusammen bringen
Am ISTA-Campus findet derzeit das NMR-Symposium von 2. bis 3. Mai statt, mit einem anschließenden zweitägigen Workshop für PhD-Studierende. „Das Symposium bringt einige der führenden Expert:innen der biologischen NMR-Spektroskopie zusammen und ist für ein breites Fachpublikum aus den Bereichen der Strukturbiologie, Biochemie und Chemie von Interesse“, erklärt Schanda. Die geladenen Referent:innen stellen die neuesten Ergebnisse ihrer Forschung vor und geben jungen Wissenschafter:innen und Teilnehmer:innen kreative Impulse für ihre Arbeit. Rovó fügt hinzu: „Es ist eine hervorragende Gelegenheit, um die NMR Facility der Öffentlichkeit vorzustellen und Kontakte zu knüpfen. Ich erwarte mir neue Kooperationen und viele gemeinsame Veröffentlichungen mit den Gruppen, die an der Konferenz teilnehmen.“
Publikation:
L. M. Becker, M. Berbon, A. Vallet, A. Grelard, E. Morvan, B. Bardiaux, R. Lichtenecker, M. Ernst, A. Loquet & P. Schanda. 2023. The Rigid Core and Flexible Surface of Amyloid Fibrils Probed by Magic-Angle-Spinning NMR Spectroscopy of Aromatic Residues. Angewandte Chemie. DOI: https://doi.org/10.1002/ange.202219314
Projektförderung:
Der ISTA-Teil des Projektes wurde durch Mittel aus dem European Research Council (StG-2012-311318 an Paul Schanda) finanziert.



