9. November 2016
Detonation im Hippocampus
IST Austria Professor Peter Jonas und Team entdecken Wechsel in neuronaler Berechnung | Studie im Journal eLife erschienen
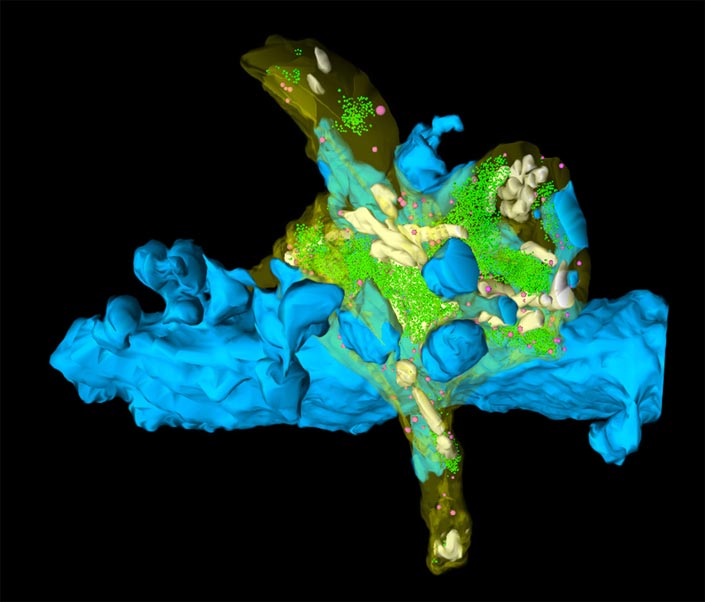
Eine Veränderung der synaptischen Plastizität führt zu einem Wechsel in der Berechnung in einer hippocampalen Synapse: das präsynaptische Neuron wechselt in den „Detonator” Modus, so dass ihr postsynaptischer Partner bereitwilliger feuert. Diese neue Erkenntnis zur Informationsverarbeitung im Gehirn publizierten Nicholas Vyleta, zuvor Postdoc am IST Austria und nun an der Oregon Health & Science University, Carolina Borges-Merjane, Postdoc am IST Austria, und Peter Jonas, Professor am IST Austria, im Open Access Journal eLife am 25. Oktober.
Synapsen bilden die Verbindungen zwischen Neuronen. Ihr Netzwerk ist verschlungen: ein einziges postsynaptisches Neuron kann mit tausenden präsynaptischen Neuronen verbunden sein. An der Synapse wird die Information vom präsynaptischen an das postsynaptische Neuron übertragen. Ein wichtiger Faktor in der Informationsverarbeitung ist die Stärke der Synapse. Die neuromuskuläre Synapse, die Verbindung zwischen Neuron und Muskel, und die Held’sche Calyx, eine Synapse im auditorischen Hirnstamm, sind starke Synapse. Auch volle Detonatoren genannt senden diese präsynaptischen Neuronen eine einziges aktivierendes Signal oder Aktionspotential aus und das postsynaptische Neuron feuert.
Ob solche Detonatoren auch im Kortex des Gehirns existieren war bis jetzt unklar. In der vorliegenden Studie untersuchen die AutorInnen die Synapse zwischen Granularzellen und CA3 Pyramidenzellen im Hippocampus. Dazu nutzen sie eine kürzlich entwickelte Methode um gleichzeitig das einzelne präsynaptische Nervenende zu stimulieren und vom damit verbundenen postsynaptischen CA3 Neuron aufzuzeichnen. Unter normalen Bedingungen führt ein einzelnes Aktionspotential der Granularzelle nicht zum Feuern des CA3 Neurons. Granularzellen sind „bedingte Detonatoren”: sie müssen Salven von Aktionspotentialen feuern, damit das CA3 Neuron ebenfalls feuert.
Dann änderten die ForscherInnen die synaptische Plastizität der Granularzelle. Sie stimulierten das einzelne präsynaptische Terminal, so dass es eine Sekunde lang mit hoher Frequenz feuerte. Das löst posttetanische Potenzierung aus, und das Bild ändert sich. Die Granularzelle wird zum vollen Detonator: Ein einzelnes Aktionspotenzial bringt das CA3 Neuron zum Feuern. Peter Jonas erklärt die Bedeutung der Studie: „Es wird generell angenommen, dass einzelne Synapsen im Gehirn schwach sind, und Dutzende bis Hunderte Eingänge integriert werden müssen um ein Neuron zu aktivieren. Die vorliegende Studie stellt diese Ansicht in Frage, in dem sie zeigt, dass volle Detonatoren im Gehirn existieren. Das hat wichtige Auswirkungen für höhergradige Berechnungen in diesem Schaltkreis.”
Synaptische Kurzzeitplastizität in der Form von posttetanischer Potenzierung ruft an der untersuchten Synapse einen Wechsel in der Berechnung hervor. Diese Veränderung ist anhaltend, und dauert einige zehntel Sekunden. Das kann wesentlich sein für Kodierung, Aufbewahrung und Abruf von Information im Netzwerk aus Granularzellen und CA3 Neuronen, wie Nicholas Vyleta hervorhebt: „Eine einzige hippokampale Moosfaser-Synapse kann nach aktivitätsabhängiger Steigerung der Transmitterfreisetzung ein Aktionspotential in einem postsynaptischen Pyramidenneuron produzieren. Dieser Wechsel in der Berechnung könnte es einem einzigen Stück hochspezifischer Information erlauben, vom Gyrus dentatus durch die hippokampale Formation übertragen zu werden, und könnte die Basis für Informationsverarbeitung durch Musterseparation in diesem Schaltkreis bilden.“
Die Studie erschien in eLife, einem Open Access Journal für die Lebenswissenschaften und Biomedizin. Das Journal wird vom Howard Hughes Medical Institute, der Max-Planck-Gesellschaft und dem Wellcome Trust unterstützt. Für Carolina Borges-Merjane und Nicholas Vyleta bietet es einige Vorteile, ihre neuen Ergebnisse in diesem Open Access Journal zu publizieren: „Unsere Arbeit in eLife zu publizieren steigert den Einfluss unserer Forschung und ihre Verfügbarkeit für andere Wissenschaftlerinnen und Wissenschaftler. eLife ist bereits als zuverlässiges Journal mit effizientem Peer Review von Wissenschaftlerinnen und Wissenschaftlern aus vielen Feldern bekannt. Unsere Erfahrungen mit Reviewern und dem Editor waren fair, effizient und ihre Kommentare sehr konstruktiv. Außerdem ist das Journal frei zugänglich, nicht nur für andere Wissenschaftlerinnen und Wissenschaftler, sondern für die Allgemeinheit, auch unsere Familien.”



