2. November 2022
Ganzes Gewebe prägt Gehirnentwicklung
Mechanismus entschlüsselt, der die Produktion von Neuronen steuert – Studie in Science Advances
Unser großes und komplexes Gehirn, insbesondere der Neokortex, ist das, was uns Menschen so einzigartig macht. Wie dieses Organ entsteht, ist jedoch noch nicht vollständig verstanden – aber relevant, da Fehler in diesem Prozess zu Krankheiten wie Mikrozephalie („kleines Gehirn“) und Makrozephalie („großes Gehirn“) führen. Nun zeigt die Gruppe von Simon Hippenmeyer am Institute of Science and Technology Austria (ISTA), dass ein gewebeübergreifender Mechanismus steuert, wie aus Stammzellen Neuronen entstehen. Dies ist das Ergebnis einer genetischen Studie an Mäusen, die in Science Advances veröffentlicht wurde.
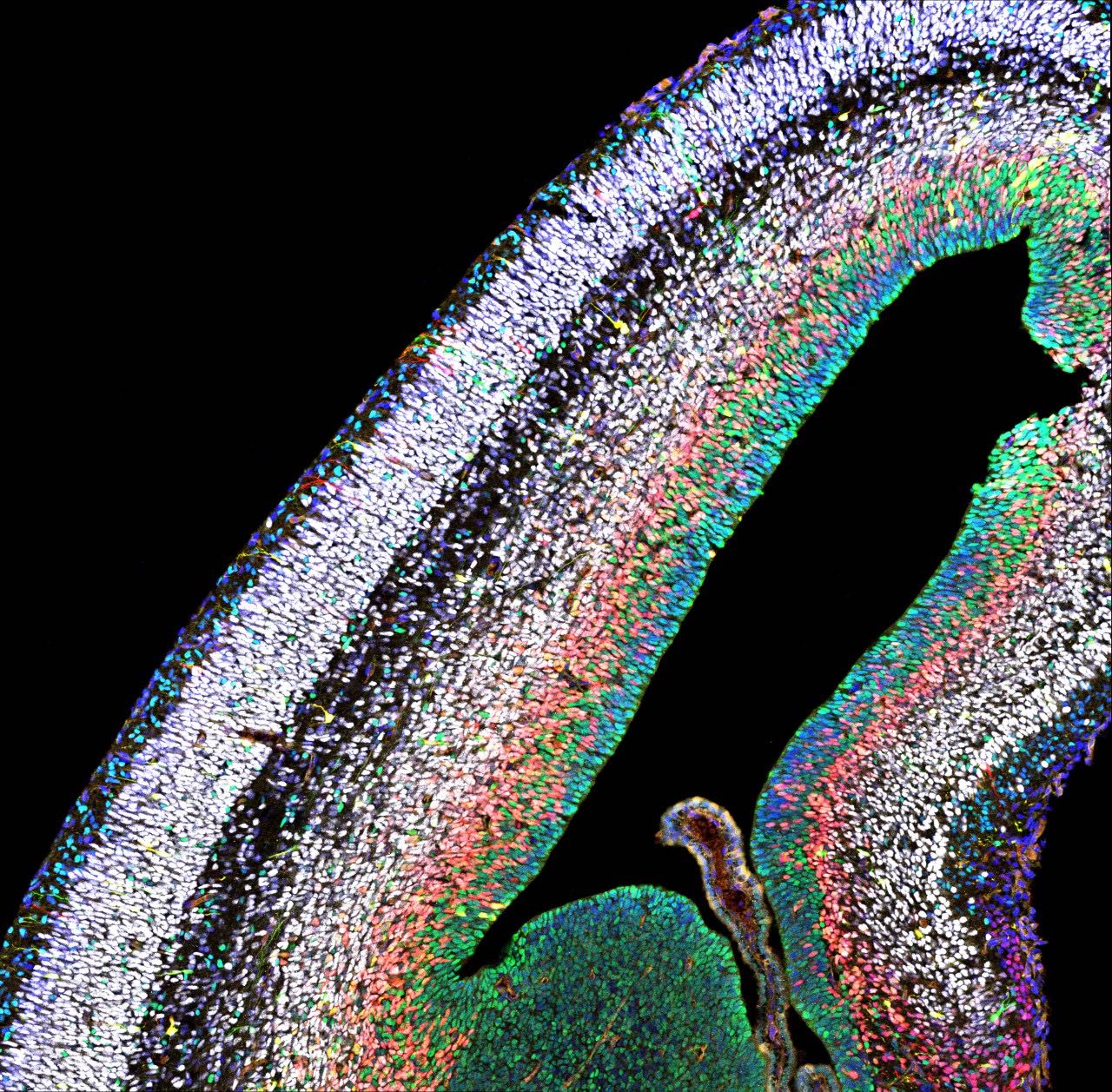
Beim Menschen ist der Neokortex der Sitz der Kognition. Er ermöglicht uns zu denken, uns etwas vorzustellen und zu träumen. Während der Embryonalentwicklung entsteht aus einem großen Pool von Stammzellen ein Kaleidoskop an Neuronen und Gliazellen, also nicht-neuronale Zellen im Gehirn. Dieser komplizierte Prozess ist jedoch fehleranfällig: Fehler können dazu führen, dass zu wenige oder zu viele Neuronen gebildet werden, wodurch Krankheiten wie Mikro- oder Makrozephalie entstehen.
Farbkodierte Neuronen geben den Ausschlag
Simon Hippenmeyer und seine Gruppe am Institute of Science and Technology Austria (ISTA) versuchten, die Mechanismen zu verstehen, welche die Erzeugung von Stammzellen, Neuronen und Glia steuern. Diese Mechanismen untersuchten sie sowohl auf der Ebene der einzelnen Stammzellen als auch im ganzheitlichen Kontext des gesamten Gewebes. Dazu nutzten sie die von Hippenmeyer etablierte MADM-Technik. Mit MADM können die Wissenschafter:innen Zellen im Gehirn farblich kodieren und gleichzeitig bestimmte Gene, die an der Gehirnentwicklung beteiligt sind, entweder nur in der einzelnen Zelle oder global im gesamten Gehirn ausschalten. „So können wir einzelne Zellen sichtbar machen und sehen, wie sie reagieren, wenn bestimmte Gene ausgeschaltet werden, entweder im gesamten Gewebe oder nur in der einzelnen Zelle“, erklärt Nicole Amberg, ehemalige Postdoktorandin in der Gruppe von Simon Hippenmeyer.
Besonderes Augenmerk legten die Neurowissenschafter:innen auf die Rolle von PRC2. PRC2 ist ein sogenannter epigenetischer Regulator, das heißt, dass PRC2 den Verpackungsgrad der DNA steuert. Der Verlust dieses Proteinkomplexes führt bei Mäusen zu einer dramatischen Mikrozephalie: ihr Neokortex ist nur halb so groß wie der von genetisch unveränderten Mäusen. Wie PRC2 die Produktion von Neuronen reguliert, war bisher unbekannt. Da epigenetische Komplexe jedoch normalerweise auf die DNA im Zellkern einwirken, hatte man geschlussfolgert, dass PRC2 höchstwahrscheinlich nur innerhalb jeder einzelnen Stammzelle agiert. Hippenmeyer und Amberg beschlossen, diese Idee zu überprüfen. „Mit MADM können wir nachverfolgen, ob Stammzellen die richtigen Arten von Neuronen in der richtigen Anzahl produzieren, sowohl wenn PRC2 nur in einer einzigen Stammzelle verloren geht als auch wenn es im gesamten Gewebe verloren geht – diese Ergebnisse vergleichen wir dann“, sagt Amberg.
Als die Forscher:innen PRC2 nur aus einer einzigen Stammzelle entfernten, blieb der Neokortex der Mäuse unverändert. „Die Stammzelle kümmert sich nicht wirklich darum und produziert eine normale Menge an Neuronen. Wenn PRC2 aus einer einzigen Stammzelle entfernt wird, verändert sich der neuronale Teil des Neokortex überhaupt nicht: Wir sehen die gleiche Anzahl von Neuronen, die gleichen Subtypen, im richtigen Verhältnis“, erinnert sich Amberg. Die Beobachtung stellte sie vor Rätsel, weil das Ausschalten von PRC2 im gesamten Gewebe ja dazu führt, dass nur noch die Hälfte der Neuronen gebildet wird. „Wo liegt also das Problem? Diese Ergebnisse deuten auf einen Mechanismus hin, der auf der Ebene des gesamten Gewebes wirkt.“
© Hippenmeyer Gruppe / Nicole Amberg
Benachbarte Zellen beeinflussen die Stammzellentwicklung
Die Forscher:innen machten sich auf die Suche und untersuchten die Aktivität der Gene. In der Tat fanden sie dramatische Unterschiede darin, welche Gene aktiv waren und welche nicht, je nachdem, ob sie PRC2 in einer einzelnen Stammzelle oder im gesamten Gewebe ausgeschaltet hatten. Wenn sie PRC2 im gesamten sich entwickelnden Neokortex ausschalteten, war das Gen auch in benachbarten Zellen, einschließlich der Stammzellen, dereguliert. Dies deutet darauf hin, dass der Verlust von PRC2 in der Stammzellennische die Entwicklung der Stammzellen beeinflusst. „Wir haben nicht erwartet, dass PRC2 eine so weitreichende Rolle spielt. Es ist überraschend, dass Nachbarzellen für die Stammzelle so wichtig sind – zumal PRC2 nicht für einen Rezeptor oder ein Signal kodiert, sondern innerhalb des Zellkerns wirkt“, sagt Hippenmeyer.
Wie sich der Verlust von PRC2 im gesamten Gewebe mechanistisch auf die Stammzellentwicklung auswirkt, ist in der Tat noch nicht klar. Weitere Ergebnisse zeigten, dass der Verlust von PRC2 zu Wellen von Genderegulierungen führt. „Das Ausschalten des PRC2-Komplexes verändert die Genexpression, was dann eine zweite Welle der Deregulierung auslöst. Und die Gene in dieser zweiten Welle sind für den Mikrozephalie-Phänotyp entscheidend“, erklärt Amberg.
Während der Verlust von PRC2 in einer einzelnen Stammzelle die Entwicklung von Neuronen nicht beeinträchtigt, wirkt sich dieser Verlust auf die Entwicklung von Astrozyten – einem wichtigen Glia-Zelltyp – aus: Nachdem eine Stammzelle die Vorläuferzellen für Neuronen hervorgebracht hat, bringt sie normalerweise Vorläuferzellen für Astrozyten hervor. Wenn PRC2 jedoch in der Stammzelle verloren geht, entwickeln sich diese Astrozyten nicht richtig.
Obwohl die Studie an Mäusen durchgeführt wurde, sind die Ergebnisse auch für die menschliche Entwicklung von Bedeutung, sagt Hippenmeyer. „Ein globaler Gen-Knockout, also das Ausschalten eines Gens im gesamten Gewebe, kann tatsächlich, schwerwiegende Folgen haben. Außerdem kann eine vererbte Mutation, die das gesamte Gewebe betrifft, zu einem schwerwiegenderen Ergebnis führen als eine Mutation, die erst später in der Embryonalentwicklung erworben wird, wenn nur wenige Zellen betroffen sind.“
Publikation:
Amberg et al. 2022. Tissue-wide Genetic and Cellular Landscape Shapes the Execution of Sequential PRC2 Functions in Neural Stem Cell Lineage Progression. Science Advances.
DOI: 10.1126/sciadv.abq1263
http://www.science.org/doi/10.1126/sciadv.abq1263
Projektförderung:
Die Erstautorin erhielt Subventionen durch das FWF Firnberg-Programm (T 1031). Die Arbeit wurde unterstützt durch ISTA institutional funds und durch den Europäische Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (Zuschussvereinbarung Nr. 725780 LinPro) für Simon Hippenmeyer.



