13. Juli 2022
Neuer Stammzell-Mechanismus im Darm entdeckt
Stammzellen im Darm werden durch neu entdeckten biophysikalischen Mechanismus gesteuert
Stammzellen sind ein heißes Thema für die Entwicklung medizinischer Behandlungen. Allerdings verstehen Wissenschafter:innen immer noch nicht ganz genau, wie sie sich teilen oder differenzieren, um Organe zu erneuern. Forscher:innen haben nun einen neuen biophysikalischen Mechanismus gefunden, der die Stammzellen im Darm von Mäusen reguliert. Dort wird eine Stammzelle nicht nur durch intrinsische molekulare Marker definiert, sondern auch durch ihren Standort und Bewegungen in ihrer Umgebung. Dies könnte zu neue Behandlungsmethoden führen.
Der Darm ist ein wundersamer Ort. Eine spezielle Zellschicht, die das Innere von Dünn- und Dickdarm auskleidet, nimmt Nährstoffe und Wasser aus der Nahrung auf und hält alles, was schlecht für den Körper ist, draußen. Diese Schicht heißt Darmepithel. Es erneuert sich vollständig alle vier bis sieben Tage mit Hilfe von Stammzellen. Dieser spezielle Zelltyp, kann sich selbst erneuern, indem er sich teilt, Und er kann sich differenzieren, um andere Zelltypen zu bilden, aus denen wiederum sich Organe erneuern. Die Wissenschafter:innen wissen jedoch immer noch nicht, wie genau diese Zellen entscheiden, was sie tun sollen.
Bernat Corominas-Murtra, ein ehemaliger Postdoc am Institute of Science and Technology Austria (ISTA) und jetzt Assistenzprofessor an der Universität Graz, und Edouard Hannezo, Professor am ISTA, arbeiteten mit einer internationalen Gruppe experimenteller Forscher:innen unter der Leitung des Teams von Jacco Van Rheenen in Amsterdam zusammen, um die Stammzellen im Darmepithel zu untersuchen. Dabei entdeckten sie einen aufregenden neuen Mechanismus, der unser Verständnis von Stammzellen verändern könnte. Ihre Ergebnisse wurden jetzt in der Zeitschrift Nature veröffentlicht.
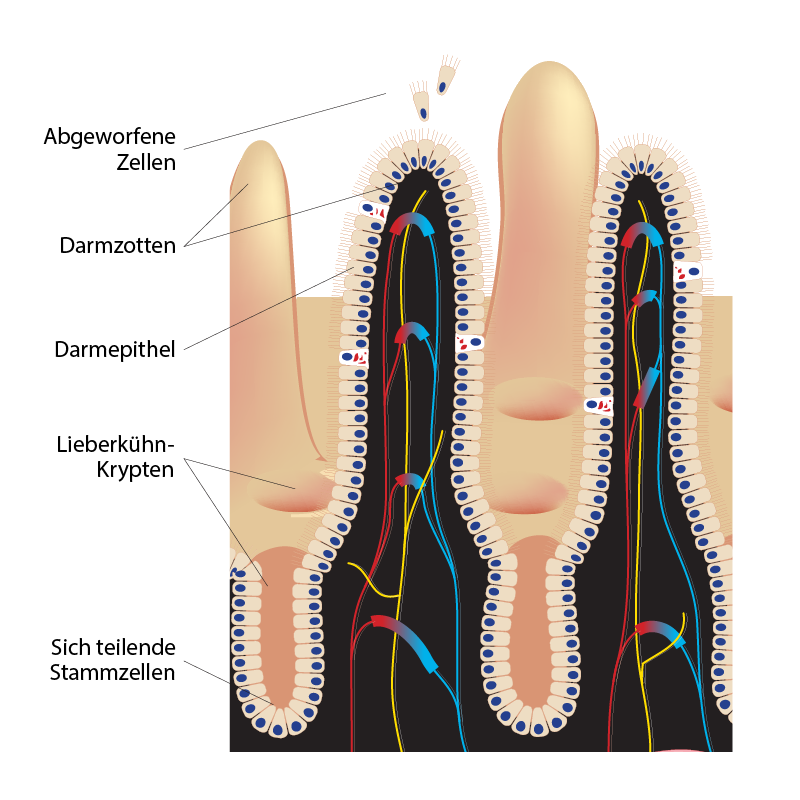
Das Darmepithel ist nur eine Zelle dick ist und wird ständig erneuert. Es überzieht alle Darmzotten, die wie winzige Tentakel aussehen und das Innere des Dünn- und Dickdarms bedecken. Zwischen den Zotten befinden sich winzige Einbuchtungen im Gewebe, die Lieberkühn-Krypten genannt werden. Dieser Name mag mysteriös klingen, und mysteriös war bisher auch, was dort geschieht. „Am Boden der Krypten teilen sich die Stammzellen des Darmepithels ständig. Ein Teil der dabei entstehenden Zellen verbleibt als Stammzellen in der Krypta, die anderen werden nach außen an die Spitze der umgebenden Zotten geschoben“, erklärt Corominas-Murtra. „Dort differenzieren sie sich schließlich zu funktionellen Zelltypen, die den Darm erst funktionieren lassen und nach einigen Tagen wieder abgestoßen werden. Das passiert ständig in unserem Körper, und wenn dieser Mechanismus versagt, kann es zu ernsthaften medizinischen Problemen kommen.“
Als sie die Stammzellen im Dünn- und Dickdarm untersuchten, waren die Wissenschafter:innen zunächst verblüfft. „Normalerweise denken wir, dass Stammzellen durch intrinsische biochemische Eigenschaften einer Zelle bestimmt werden – so etwas wie ein biochemischer Marker, den wir identifizieren können“, fährt Corominas-Murtra fort. „Wir fanden heraus, dass unter den Zellen, die diesen traditionellen Stammzellmarker hatten, viele von ihnen nie wirklich als Stammzellen funktionierten. Stattdessen werden sie aus den Krypten verdrängt und entsorgt, ohne überhaupt zur langfristigen Erneuerung des Darms beizutragen. Wir sahen auch, dass die klassischen Marker zwar etwa die gleiche Anzahl von Stammzellen im Dünn- und Dickdarm vorhersagten, dass aber im Dünndarm etwa doppelt so viele von ihnen tatsächlich als Stammzellen arbeiteten wie im Dickdarm.“ Die Wissenschafter:innen wollten daher verstehen, was für ein Mechanismus bestimmt, welche Zellen tatsächlich als Stammzellen fungieren. Sie fanden einen überraschenden neuen Mechanismus, der die Stammzellen in den Krypten reguliert.
„Wir haben herausgefunden, dass es auf den Standort ankommt, ob eine Zelle als Stammzelle funktioniert oder nicht! Die Zellen im Darmepithel werden nicht nur von den Zellteilungen aus der Krypta herausgeschoben – wie auf einem Fließband –, sondern es ist noch eine andere Art von Bewegung im Spiel“, erklärt Corominas-Murtra. Die Wissenschafter:innen fanden heraus, dass sich Zellen im Darmepithel auch aktiv in zufällige Richtungen bewegen – vor und zurück auf dem Förderband, wenn man so will. Auf diese Weise können Zellen, die bereits ein kleines Stück entlang des Förderbands geschoben wurden, wieder an der Basis der Krypta landen. Dort können sie dann erneut als Stammzellen fungieren, um sich zu teilen und das Darmepithel zu erneuern. Edouard Hannezo erklärt die möglichen Auswirkungen dieser Ergebnisse: „Diese Bewegungen stellen einen neuen Mechanismus basierend auf der Umgebung dar, der bestimmt, welche Zellen funktionell als Stammzellen fungieren können. Im Dünndarm ist das molekulare Signal, das diese Bewegungen steuert, stärker als im Dickdarm, sodass die Zellen häufiger in die Krypta zurückwandern können. Dies erklärt, warum es im Dünndarm mehr tatsächlich funktionierende Stammzellen gibt als im Dickdarm. Dies könnte große Auswirkungen auf unser Verständnis davon haben, was eine Stammzelle eigentlich ist und wie man sie in der Medizin einsetzen kann.“
Diese Erkenntnis stützt sich auf frühere Ergebnisse von Bernat Corominas-Murtra und Edouard Hannezo am ISTA und die Arbeit der Van Rheenen-Gruppe. Ursprünglich aus der Physik kommend, entwickelten Corominas-Murtra und Hannezo ein komplexes mathematisches Modell des Darmepithels, das die Bewegung der Zellen sowohl von der Krypta weg als auch zurück zu ihr abbildet. Mit Hilfe ihres Modells konnten sie die Anzahl der tatsächlich funktionierenden Stammzellen in Dünn- und Dickdarm vorhersagen. Eine Reihe anderer Forschergruppen aus ganz Europa entwickelte Experimente mit den neuesten Methoden der Mikroskopie und Genetik, um die Vorhersagen zu testen, und sie erwiesen sich als zutreffend. Sie versuchten sogar, das chemische Signal in den Krypten zu hemmen und stellten fest, dass sich dadurch die Anzahl der funktionierenden Stammzellen wie vorhergesagt reduzierte.

Weitere Links:
Mehr über Bernat Corominas-Murtra’s Forschung bei ISTA:
- https://ista.ac.at/de/news/ordnung-durch-unordnung/
- https://ista.ac.at/de/news/embryonales-gewebe-zwischen-fest-und-fluessig/
Mehr über Edouard Hannezos Forschung am ISTA:
- https://ista.ac.at/de/news/wie-zellen-kurven-spueren/
- https://ista.ac.at/de/news/wundheilende-wellen/
Publikation:
M. Azkanaz, B. Corominas-Murtra, et al. 2022. Retrograde movements determine effective stem cell numbers in intestinal crypts. Nature. DOI: 10.1038/s41586-022-04962-0
Projektförderung
Bezüglich Beiträgen im Zusammenhang mit ISTA, dankt Bernat Corominas-Murtra für die Unterstützung durch den Exzellenzbereich „Complexity of life in basic research and innovation“ der Universität Graz und Edouard Hannezo für die Förderung durch den Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (Finanzhilfevereinbarung Nr. 851288). Weitere Einzelheiten finden Sie im Abschnitt über die Finanzierung in der Publikation.
Information zu Tierwohl
Um grundlegende Prozesse etwa in den Bereichen Neurowissenschaften, Immunologie oder Genetik besser verstehen zu können, ist der Einsatz von Tieren in der Forschung unerlässlich. Keine anderen Methoden, wie zum Beispiel in-silico-Modelle, können als Alternative dienen. Die Tiere werden gemäß der strengen in Österreich geltenden gesetzlichen Richtlinien aufgezogen, gehalten und behandelt. Alle tierexperimentellen Verfahren sind durch das Bundesministerium für Bildung, Wissenschaft und Forschung genehmigt.



