5. Februar 2024
Des (Pocken)Virus Kern
ISTA-Forscher:innen entschlüsseln die Architektur von Pockenvirus-Kernen
Der jüngste Ausbruch von Mpox-Viren brachte Pockenviren wieder auf die Tagesordnung der öffentlichen Gesundheit, und machte dabei eine wichtige Wissenslücke deutlich – im Kern der Sache. Nun lüftete ein Forschungsteam des Institute of Science and Technology Austria (ISTA) die Geheimnisse der Kernarchitektur von Pockenviren – durch die Kombination verschiedener Kryo-Elektronenmikroskopie-Techniken mit molekularer Modellierung. Die Ergebnisse, die im Journal Nature Structural & Molecular Biology veröffentlicht wurden, könnten den Grundstein für die künftige Erforschung neuer Therapeutika legen.

Das Variola-Virus, der Verursacher von Pocken und eines der tödlichsten Viren, die den Menschen befallen haben, hat bis zu seiner Ausrottung im Jahr 1980 verheerende Schäden angerichtet. Die Überwindung dieses berüchtigten Vertreters der Pockenviren gelang dank einer umfassenden Impfkampagne mit dem Vacciniavirus, einem anderen Angehörigen der Pockenviren-Familie. Das Wiederauftauchen und der Ausbruch des Mpox-Virus in den Jahren 2022-2023 erinnerte einmal mehr daran, dass Viren immer wieder eine Bedrohung für die öffentliche Gesundheit sein können. Vor allem aber hat es grundlegende Fragen zu Pockenviren deutlich gemacht, die bis heute unbeantwortet geblieben sind.
Eine dieser grundlegenden Fragen betrifft – buchstäblich – den Kern der Sache: „Wir wissen, dass Pockenviren nur dann infektiös sein können, wenn ihr viraler Kern vollständig geformt ist. Aber woraus besteht dieser ‚Pockenvirus-Kern‘, der gemeinsame Kern der klinisch relevanten Pockenviren, und wie setzen sich seine einzelnen Komponenten zusammen und wie funktionieren sie?“, fragt Florian Schur, Assistenzprofessor am Institute of Science and Technology Austria (ISTA), und leitender Autor der Studie. Schur und sein Team haben nun das fehlende Bindeglied ausfindig gemacht: ein Protein namens A10. Interessanterweise verfügen alle klinisch relevanten Pockenviren über dieses Protein. Darüber hinaus fanden die Forscher:innen heraus, dass A10 als einer der Hauptbausteine des Pockenvirus-Kerns fungiert. Dieses Wissen könnte die künftige Erforschung von Therapeutika ermöglichen, die auf die Kerne von Pockenviren abzielen.

„Die fortschrittlichsten Kryo-EM-Techniken“
Der virale Kern ist einer der Faktoren, die allen infektiösen Arten von Pockenviren gemeinsam haben. „Frühere Experimente in der Virologie, Biochemie und Genetik legten mehrere mögliche Pockenvirus-Kernproteine nahe, aber es waren keine experimentell abgeleiteten Strukturen verfügbar“, sagt Julia Datler, PhD-Studentin am ISTA und eine der Erstautor:innen der Studie. Daher begann das Team mit der Computer-Modellierung der Strukturen der wichtigsten Kernproteinkandidaten, wobei es die inzwischen berühmte künstliche Intelligenz AlphaFold einsetzte. Parallel dazu legte Datler die biochemischen und strukturbiologischen Grundlagen des Projekts, indem sie ihren Hintergrund in der Virologie und die Hauptkompetenz der Schur Gruppe einbrachte: die kryogene Elektronenmikroskopie, kurz ‚Kryo-EM‘. „Wir haben viele der fortschrittlichsten verfügbaren Kryo-EM-Techniken mit der strukturellen Modellierung durch AlphaFold kombiniert. Dadurch erhielten wir zum ersten Mal einen detaillierten Überblick über den Pockenvirus-Kern – den ‚Bioreaktor‘ im Inneren des Virus, der das virale Genom umschließt und es in infizierten Zellen freisetzt“, sagt Schur. „Es war ein ziemliches Wagnis, aber wir haben es schließlich geschafft, die richtige Kombination von Techniken zu finden, um diese komplexe Frage zu untersuchen“, sagt Jesse Hansen, Postdoktorand und Co-Erstautor der Studie, dessen Fachkenntnisse in verschiedenen strukturbiologischen Techniken und Bildverarbeitungsmethoden entscheidend waren.
Pockenvirus aus allen Blickwinkeln
Die ISTA-Forscher:innen verwendeten das im Labor vorhandene und ungefährliche Vacciniavirus als Pockenvirus-Modell. Sie untersuchten ganze, reife Vacciniavirus-Virionen, sowie aus ihnen isolierte und aufgereinigte Viruskerne – und das im wahrsten Sinne des Wortes unter allen möglichen Blickwinkeln. „Wir haben die ‚klassische‘ Einzelpartikel-Kryo-EM mit der Kryo-Elektronentomographie, der Untertomogramm-Mittelung und der AlphaFold-Analyse kombiniert, um einen Gesamtüberblick über den Pockenvirus-Kern zu erhalten“, sagt Datler. Die Kryo-Elektronentomographie ermöglicht es den Wissenschafter:innen 3D-Volumina einer biologischen Probe bis zur Größe eines ganzes Virus zu rekonstruieren, indem sie Bilder aufnehmen, während sie die Probe schrittweise kippen. „Es ist, als würde man einen CT-Scan des Virus machen“, sagt Hansen. „Die Kryo-Elektronentomographie, die Spezialität unserer Forschungsgruppe, ermöglichte es uns, Auflösungen im Nanometerbereich für das gesamte Virus, seinen Kern und sein Inneres zu erreichen“, sagt Schur. Darüber hinaus konnten die Forscher:innen die AlphaFold-Modelle wie ein Puzzle in die beobachteten Formen einpassen und Moleküle identifizieren, die den Kern des Pockenvirus bilden. Darunter stach der Kernprotein-Kandidat A10 als eine der wichtigsten Komponenten hervor. „Wir haben herausgefunden, dass A10 zentrale Strukturelemente des Kerns von Pockenviren definiert“, sagt Datler. Schur fügt hinzu: „Diese Ergebnisse sind eine großartige Quelle für die Interpretation der in den letzten Jahrzehnten gewonnenen strukturellen und virologischen Daten.“
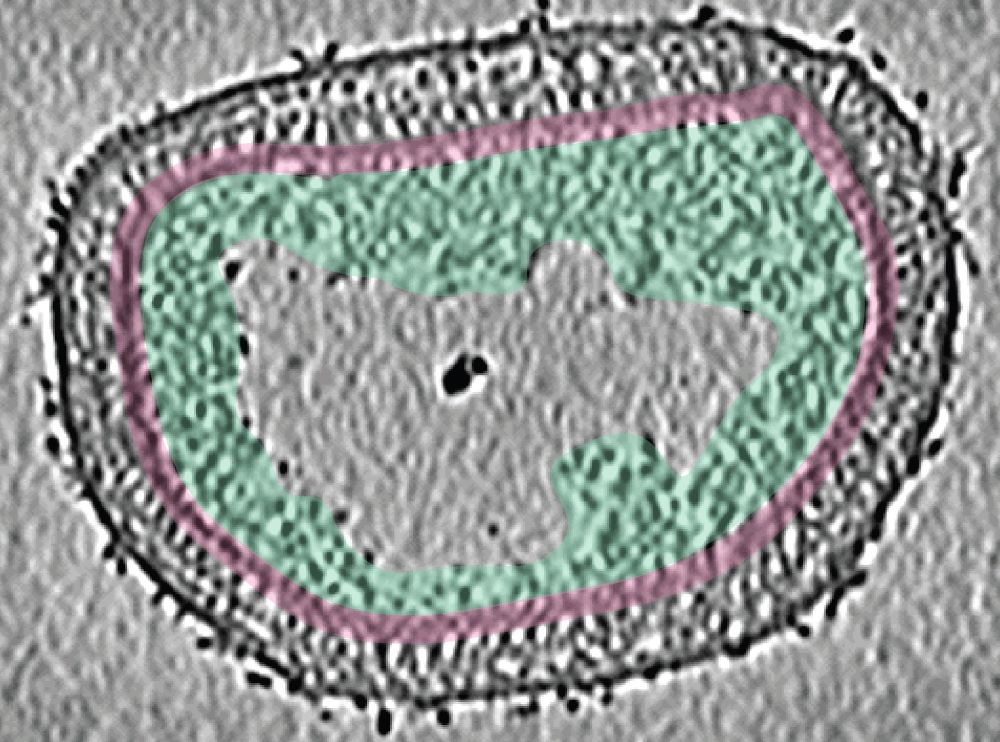

Ein steiniger Weg zur Entdeckung von Pockenvirus-Kernen
Der Weg zu diesen Erkenntnissen war kein leichtes Unterfangen. „Wir mussten von Anfang an unseren eigenen Weg finden“, sagt Datler. Sie nutzte dafür ihr Fachwissen in Biochemie, Virologie und Strukturbiologie: Datler isolierte, vermehrte und reinigte Proben des Vacciniavirus auf, erstellte die Protokolle zur Aufreinigung des gesamten Viruskerns, während sie gleichzeitig diese Proben für strukturelle Untersuchungen optimierte. „Strukturell war es extrem schwierig, diese Viruskerne zu untersuchen. Aber zum Glück haben sich unsere Beharrlichkeit und unser Optimismus ausgezahlt“, sagt Hansen.
Die ISTA-Forscher:innen sind überzeugt, dass ihre Erkenntnisse ein Sprungbrett für künftige Therapeutika bieten könnten, die auf Pockenvirus-Kerne abzielen. „Man könnte zum Beispiel an Medikamente denken, die den Pockenvirus-Kern daran hindern, sich zusammenzusetzen – oder sogar sich zu zerlegen und die virale DNA während der Infektion freizusetzen. Letztlich erlaubt uns die hier betriebene grundlegende Virusforschung, besser auf mögliche zukünftige Virusausbrüche vorbereitet zu sein“, schließt Schur.

Alle Mitautor:innen dieser Arbeit sind mit dem Institute of Science and Technology Austria (ISTA) verbunden. Diese Zusammenarbeit erfolgte zwischen Mitgliedern der Schur Gruppe (Julia Datler, Jesse M. Hansen, Andreas Thader, Lukas W. Bauer, Florian K. M. Schur), der Scientific Computing Unit (Alois Schlögl) und der Electron Microscopy Facility (Victor-Valentin Hodirnau) am ISTA.
Publikation:
Datler J, Hansen JM, et al. 2024. Multi-modal cryo-EM reveals trimers of protein A10 to form the palisade layer in poxvirus cores. Nature Structural & Molecular Biology. DOI: 10.1038/s41594-023-01201-6
Projektförderung:
Dieses Projekt wurde durch Mittel aus der Chan Zuckerberg Initiative (DAF2021-234754 und DOI: 10.37921/812628ebpcwg) sowie dem Österreichischen Wissenschaftsfonds (FWF) (P31445) finanziert.



